动脉粥样硬化是一种由慢性血管炎症驱动的复杂性疾病,主要起始于高脂血症和异常剪切应力所引发的血管内皮损伤。尽管当前临床广泛应用的降脂药物(如他汀类和PCSK9抑制剂)能够显著降低胆固醇水平,但它们仍难以有效遏制动脉粥样硬化相关主要心血管事件的持续上升。这一治疗瓶颈凸显了深入解析疾病进展中新型分子机制的迫切需求。血管内皮细胞在维持血管稳态中扮演重要角色,其功能障碍被认为是启动和推动动脉粥样硬化等慢性血管炎症性疾病发生发展的关键环节。然而,目前对动脉粥样硬化进程中内皮细胞病理表型的精细转录图谱、调控网络及其分子特征仍缺乏系统性的认识。
2026年1月6日,浙江大学生命科学学院遗传与再生生物学研究所余路阳/裘聪团队在EMBO Journal杂志在线发表题为“A fibroblast-like endothelial cell state promotes atherosclerosis via C/EBPβ-activated TGF-β signaling”的研究论文。该研究报道了在动脉粥样硬化中存在的一群独特的促血管炎症的成纤维样内皮细胞的分子特征,并揭示了调控此类内皮细胞病理表型的分子机制,为动脉粥样硬化的治疗提供新靶点。

研究团队首先对正常小鼠、轻度动脉粥样硬化小鼠以及重度动脉粥样硬化小鼠主动脉中的内皮细胞进行了单细胞转录组测序,成功鉴定出一类独特的“成纤维细胞样”内皮细胞亚群。该亚群显著高表达成纤维细胞标志物、细胞外基质相关基因以及多种炎症因子。值得注意的是,这些细胞并不表达平滑肌细胞标志物(如Acta2和Tagln),提示其可能代表一种区别于经典内皮-间充质转化的新型病理表型。此外,该亚型标志性基因的表达水平随疾病进展而逐步升高,进一步表明其在动脉粥样硬化发生发展中具有重要的功能参与。
研究人员进一步对这类成纤维细胞样内皮细胞中的转录因子网络进行了系统性分析,以揭示其表型形成的调控机制。结果发现,转录因子C/EBPβ在该细胞亚群中显著高表达,且其表达水平与动脉粥样硬化病变的严重程度呈正相关。研究团队结合RNA-Seq与一系列体外细胞和分子生物学实验,在人主动脉内皮细胞模型中明确证实C/EBPβ是驱动这一新型内皮病理表型形成的关键调控因子。
在分子机制层面,研究发现C/EBPβ通过上调TGF-β受体I(TGFBR1)的表达,从而激活TGF-β信号通路,并由此引发下游一系列促炎和促纤维化反应。更深入的机制解析表明,C/EBPβ能够直接结合到TGFBR1基因的启动子区域,促进其转录激活,进而增强TGF-β信号通路的整体活性。
最后,团队人员在体内实验中对C/EBPβ功能进行了验证。内皮细胞特异性过表达C/EBPβ的小鼠表现出动脉粥样硬化斑块面积显著增大、血管炎症反应加剧,同时伴随内皮TGFβR1表达水平升高。这些结果确证了C/EBPβ在驱动动脉粥样硬化进展中的核心作用,并进一步支持C/EBPβ–TGF-β信号轴作为潜在治疗靶点的可行性。
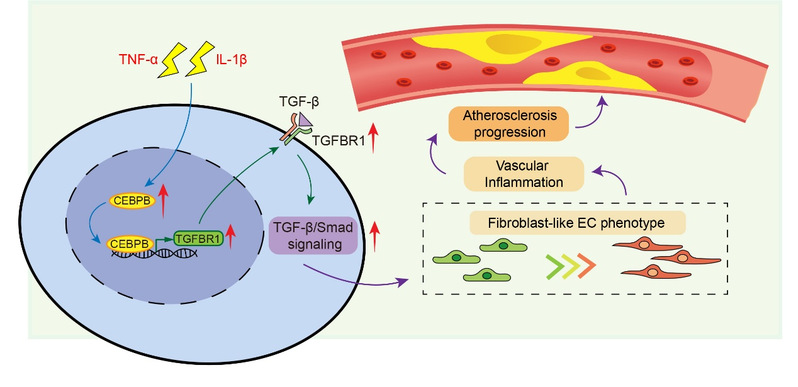
综上所述,该研究不仅阐明了“成纤维样内皮细胞”这一新型病理亚型的分子定义及C/EBPβ-TGF-β调控轴的精确机制,更指明了靶向C/EBPβ-TGF-β通路的治疗潜力,为开发针对内皮细胞功能障碍的创新疗法提供了新的靶点。
浙江大学生命科学学院博士研究生樊林鸽及朱颖奕为论文的共同第一作者。余路阳教授和裘聪副研究员为论文的共同通讯作者。这项工作得到了国家重点研发、国家自然科学基金,以及中央高校基本科研业务经费等的资助以及生命科学学院徐良研究员团队的大力支持。
原文链接:https://link.springer.com/article/10.1038/s44318-025-00684-x