糖基化修饰在生命活动中发挥着不可或缺的作用。核心岩藻糖基化是岩藻糖以α-1,6糖苷键的形式与N-聚糖五糖核心中最内层的GlcNAc连接的一种糖基化修饰。该修饰在哺乳动物细胞中普遍存在,其失调与肿瘤等人类疾病的发生发展密切相关。大量研究表明核心岩藻糖基化在肝癌等多种恶性肿瘤中显著上调,并与肿瘤生长、侵袭、迁移以及免疫逃逸等恶性行为密切相关。例如核心岩藻糖基化可通过修饰PD-1,PD-L2和B7H3等免疫抑制性分子,影响CD8+ T细胞活性,调节肿瘤适应性免疫应答。然而,核心岩藻糖基化在肿瘤先天免疫中的作用仍不明确。
CD47属于免疫球蛋白超家族,是一种跨膜糖蛋白,在体内几乎所有细胞的表面都有表达。CD47主要通过与免疫细胞表面的信号调节蛋白α(SIRPα)结合,发出“不要吃我”的信号,抑制巨噬细胞(MC)的吞噬作用,从而有助于维持非恶性细胞在生理条件下的免疫耐受性。然而大量的研究发现CD47在多种肿瘤中(包括肝癌)表达上调,导致MC对肿瘤细胞的吞噬作用减弱,促进了肿瘤细胞的免疫逃逸。因此,阻断 CD47/SIRPα信号轴已成为继PD-1/PD-L1后恶性肿瘤的下一代免疫检查点抑制策略。目前,已有一些CD47靶向抗体或药物已进入临床前或临床试验阶段。然而正常细胞如红细胞和血小板上也高表达 CD47,单独靶向 CD47会导致严重的脱靶效应,促使MC攻击功能正常的红细胞,引发贫血、溶血等严重不良反应。因此,深入探索CD47的表达调控机制并在此基础上进一步开发针对CD47/SIRPα 信号轴的药物靶点,对于克服靶向 CD47导致的脱靶副作用至关重要。
近日,浙江大学生命科学学院生物化学研究所易文/朱强团队在Advanced Science杂志在线发表题为“Core Fucosylation Represses SMURF1-Dependent Degradation of CD47 to Promote Tumor Immune Evasion”的研究论文。该研究报道了CD47的核心岩藻糖基化重塑肝细胞癌免疫微环境的新机制,为肝细胞癌的临床治疗提供新思路。

研究团队首先通过凝集素以及化学酶联标记的方法证实了CD47蛋白具有高度的核心岩藻糖修饰,同时通过质谱检测结合点突变的生化手段,确定了天冬酰胺N111位(N111)是CD47的主要核心岩藻糖修饰位点(图1A和1B)。通过细胞生物学实验,研究人员验证了N111位上的核心岩藻糖基化减弱了CD47与泛素连接酶SMURF1的结合,从而抑制了CD47的泛素化降解,促进了CD47蛋白表达。阻断N111的核心岩藻糖基化会降低CD47的表达,促进MC对肿瘤细胞的吞噬,增强CD103+树突状细胞(DCs)的浸润以及自然杀伤(NK)细胞的募集,抑制肿瘤生长(图1C-1F)。此外,使用核心岩藻糖基化抑制剂2F-Fuc能联合CD47单抗协同抑制肝原位肿瘤生长(图1G)。临床样本分析发现核心岩藻糖基转移酶FUT8的表达在肝癌样品中显著升高,与CD47的表达呈显著正相关,与DC和NK的浸润水平呈显著负相关(图1H-1J), 提示CD47的核心岩藻糖基化在肝癌临床免疫治疗中具有重要意义。
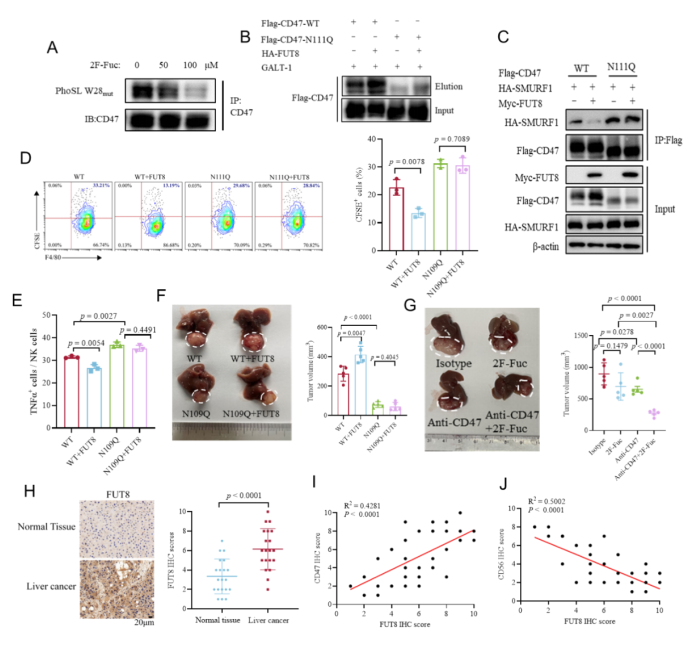
图1:CD47核心岩藻糖基化促进肝癌免疫逃逸
总之,该研究揭示了核心岩藻糖基化调控肿瘤免疫逃逸的新机制(图2),强调干预CD47的核心岩藻糖基化可以作为肝细胞癌临床治疗的潜在策略。
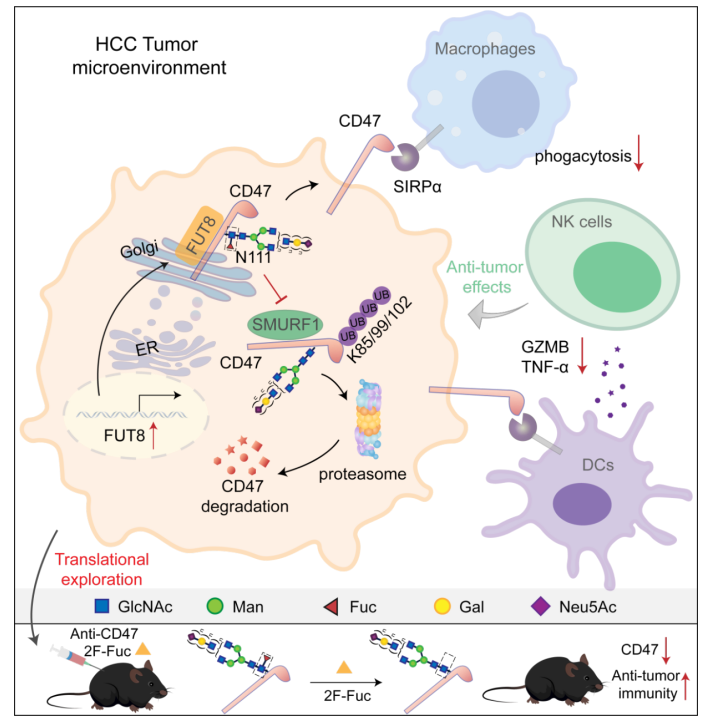
图2:CD47核心岩藻糖基化调控肿瘤免疫逃逸工作模式图
浙江大学生命科学学院博士研究生曹玉婷为论文的第一作者。易文教授和朱强研究员为论文的共同通讯作者。这项工作得到了国家重点研发、面上和青年基金,以及浙江大学创新团队建设经费的资助。
原文链接:http://doi.org/10.1002/advs.202516863