对全球数亿糖尿病患者而言,皮下注射胰岛素仍是1型糖尿病与晚期2型糖尿病的标准治疗方案。但每日注射伴随的疼痛感与心理恐惧,让儿童、老年患者等群体尤为抗拒;反复注射还易引发皮肤感染、脂肪增生,间接影响药物吸收;部分患者因治疗依从性不足擅自减少注射次数,导致血糖控制不佳——这一“注射困境”长期困扰糖尿病临床治疗。长期以来,科研界一直致力于胰岛素无创给药技术的探索。但皮肤作为人体隔绝外界物质的天然屏障,仅允许特定结构的小分子穿透,胰岛素等生物大分子药物因分子量大、结构复杂,难以突破这层壁垒。生物大分子的无损透皮给药至今未能实现。

针对这一领域痛点,浙江大学生命科学学院周如鸿团队与合作者在《Nature》上发表题为“A skin-permeable polymer for non-invasive transdermal insulin delivery”的研究论文,首次提出了颠覆性的解决方案。该研究首次报道了一种皮肤渗透性高分子——聚[2-(N-氧化物-N,N-二甲基氨基)乙基甲基丙烯酸酯](OP),成功实现胰岛素无创透皮给药,其胰岛素键合物(OP-I)在糖尿病动物模型中,展现出与皮下注射胰岛素相当的降糖疗效。
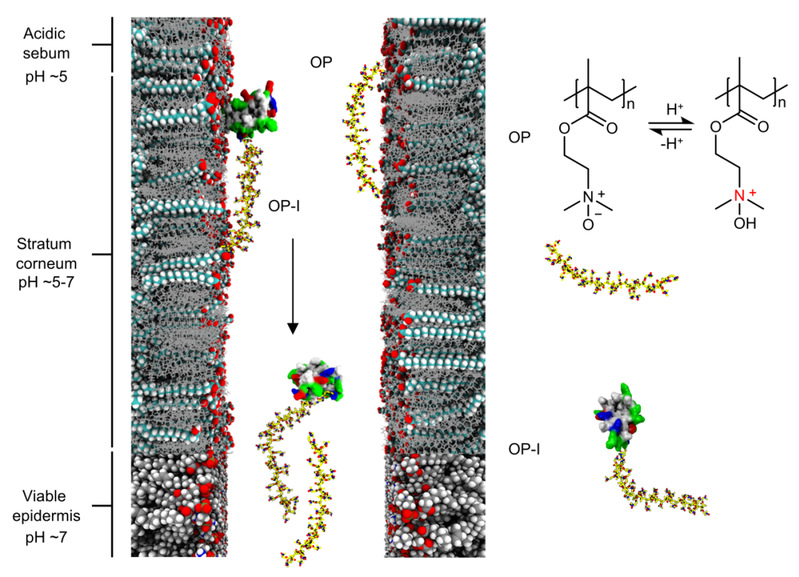
图2. OP-I的皮肤渗透机制
该研究的核心创新,在于通过理论模拟与相关实验构建了“皮肤生理pH梯度适配的智能递药机制”,具体分为三阶段:
1. 皮肤表面的靶向富集(pH≈5,弱酸性环境)
OP含有可质子化的三级胺氧化物基团,在皮肤表面(皮脂膜及角质层表层)弱酸性条件下发生质子化,使OP带正电。通过静电相互作用,OP与角质层细胞间隙带负电的脂肪酸紧密结合,形成局部高浓度药物储库,为后续渗透提供浓度梯度。
2. 表皮层的高效渗透(pH≈7,中性环境)
随渗透深度增加,角质层内侧至活性表皮层的pH升至中性,OP发生去质子化转变为电中性聚两性离子,与角质层脂质的静电相互作用大大减弱,亲疏水性改变,可自由通过角质细胞间隙,区别于传统化学促渗剂的屏障破坏机制。
3. 深层皮肤的跳跃递送
在活性表皮层及真皮层,OP-I不会被细胞摄取,而是沿细胞膜表面发生“跳跃式移动(hopping)”,有效避开了细胞内酶的降解,快速渗透皮肤,最终经真皮层淋巴管进入体循环,实现全身递送。
研究团队首先利用分子动力学模拟与自由能微扰计算等阐明了分子机制:弱酸性环境(pH 5.5)下,OP-I与角质层的结合自由能显著高于胰岛素,从而促进其在角质层表面吸附与富集;基于斯托克斯–爱因斯坦关系的分析显示,OP-I在角质层界面的摩擦系数远低于胰岛素,表明其扩散性能更优、更易向深层迁移;进入中性环境(pH 7)后,OP-I与皮肤脂质不再有效结合,助力其渗透至活性表皮层。为系统验证该透皮给药技术的有效性与安全性,研究团队紧接着在两种糖尿病模型动物中开展评估。OP-I可高效靶向肝脏、脂肪、肌肉等血糖调控关键组织,这为其强效降糖效应提供了明确机制支撑。具体而言,对STZ诱导的糖尿病小鼠经皮给予116 U/kg OP-I,血糖在1 h内即可快速降至正常范围,降糖效果与皮下注射胰岛素相当,药效持续时间延长至12 h以上且无低血糖风险,SPR实验进一步表明,OP-I与胰岛素受体的结合能力与天然胰岛素相当;针对皮肤结构更接近人类的糖尿病迷你猪,仅需29 U/kg的经皮给药剂量,即可实现血糖正常化。持续给药后,动物皮肤角质层结构完整、细胞间隙无扩张,也没有出现炎症、细胞凋亡等副作用,证明该技术的安全性。
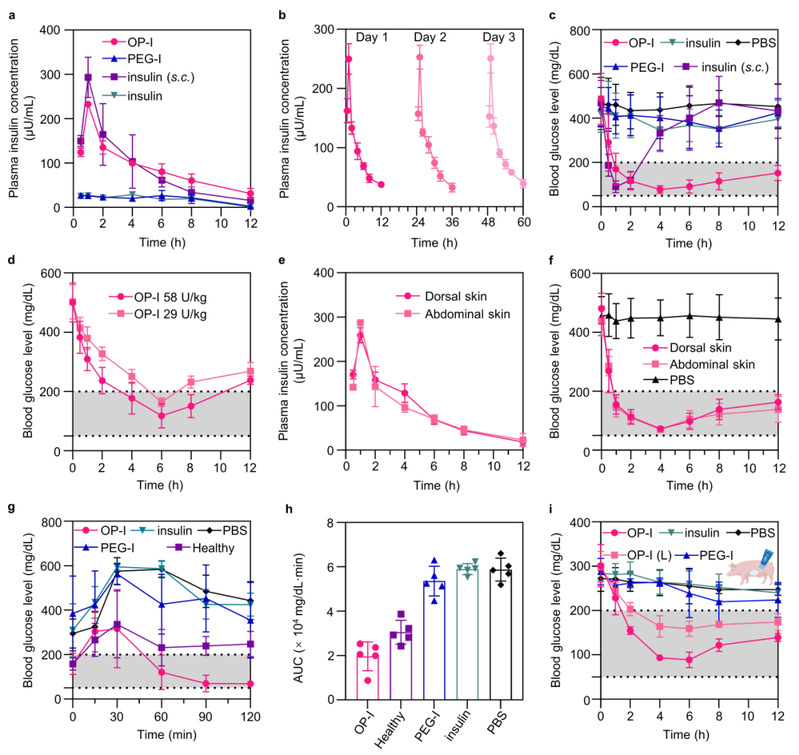
图3. OP-I经皮给药后的降糖效果
这一重大发现对糖尿病患者而言,显示“告别针头”不再是奢望。随着该技术持续推进临床研究,未来可能只需通过皮肤涂药便可实现血糖平稳控制,显著提升治疗便利性与依从性。目前,该体系已成功拓展至利拉鲁肽、司美格鲁肽、治疗性蛋白、单克隆抗体及siRNA等多类生物大分子,证实其具有普适性,为生物大分子无损透皮给药开辟全新研究方向。

该工作与浙江大学化学与生物工程学院申有青教授团队,帝国理工学院陈荣军教授团队合作完成。浙江大学生命科学院博士后何至为该论文的共同第一作者,浙江大学周如鸿教授为共同通讯作者,浙江大学生命科学学院博士生付雅琪、徐铭宇参与了本工作。这项工作得到了国家重点研发计划、国家自然科学基金、国家生物药技术创新中心、国家自主创新示范区上海张江重大项目、浙江大学上海高等研究院繁星基金等资助。
原文链接:https://www.nature.com/articles/s41586-025-09729-x?sessionid=