脊索瘤是一种源自脊索残余组织的恶性肿瘤,常见于颅底、脊柱及骶骨等部位,虽然其生长较为缓慢,但却具有显著的局部侵袭性。手术依然是治疗脊索瘤的首选方法,但由于肿瘤位于大脑、重要神经和血管附近,完全切除极具挑战,导致复发率较高,因此亟需有效的辅助治疗策略。然而,脊索瘤对常规放疗和化疗均表现出较强的耐受性,目前尚未出现成熟靶向治疗、细胞毒性治疗或免疫治疗方案。尽管高剂量放疗(>74 Gy)可能改善疗效,但会显著增加神经系统损伤的风险;而化疗效果有限,更加限制了患者的治疗选择。
近日浙江大学生命科学学院周如鸿教授团队与苏州大学附属第一医院合作在ACS Nano上发表题为“Overcoming Radiotherapy Resistance in Chordoma through the Synergistic Action of Selenium-containing Nanoparticles and THZ1”的研究成果。研究基于脊索瘤的生物学特性,开发了一种靶向药物递送系统,将CDK7抑制剂THZ1封装在含有双硒键的纳米颗粒中。双硒键作为X射线和活性氧(ROS)的双重响应释放触发元件,能够在低剂量X射线(如2 Gy)照射和肿瘤微环境中ROS水平升高时发生断裂,并转化为硒酸(RSeOOH)。这一转化过程促使纳米载体迅速解体并释放THZ1。RSeOOH与THZ1的协同作用通过激活p53信号通路,诱导细胞凋亡,并阻滞U-CH1细胞于G2/M期,显著提高了放疗的敏感性,有效克服了脊索瘤对放疗的耐受性。

在探索脊索瘤治疗策略的过程中,T-box转录因子T(Brachyury,TBXT)在脊索瘤细胞中的显著过表达引起了研究者的关注。抑制细胞周期蛋白依赖性激酶(CDKs),特别是CDK7/9/12/13,可有效下调Brachyury表达,并抑制脊索瘤细胞增殖,其中CDK7因其关键调控作用成为潜在的治疗靶点。CDK7通过磷酸化RNA聚合酶II(RNAPII)C末端结构域来维持转录活性,并调控多种与肿瘤生存相关的转录程序。THZ1通过与CDK7的Cys312残基形成共价键,抑制其激酶活性,从而阻断肿瘤细胞增殖。此外,THZ1还可通过共价结合CDK12和CDK13上与Cys312同源的半胱氨酸残基,抑制这两种RNAPII相关激酶。THZ1不仅能诱导G2/M期细胞周期阻滞,还能增强肿瘤细胞对放疗的敏感性。然而,由于THZ1对CDK12和CDK13的广谱抑制,可能引发脱靶毒性,如疲劳、胃肠道反应及高血糖,从而限制其临床应用的潜力。
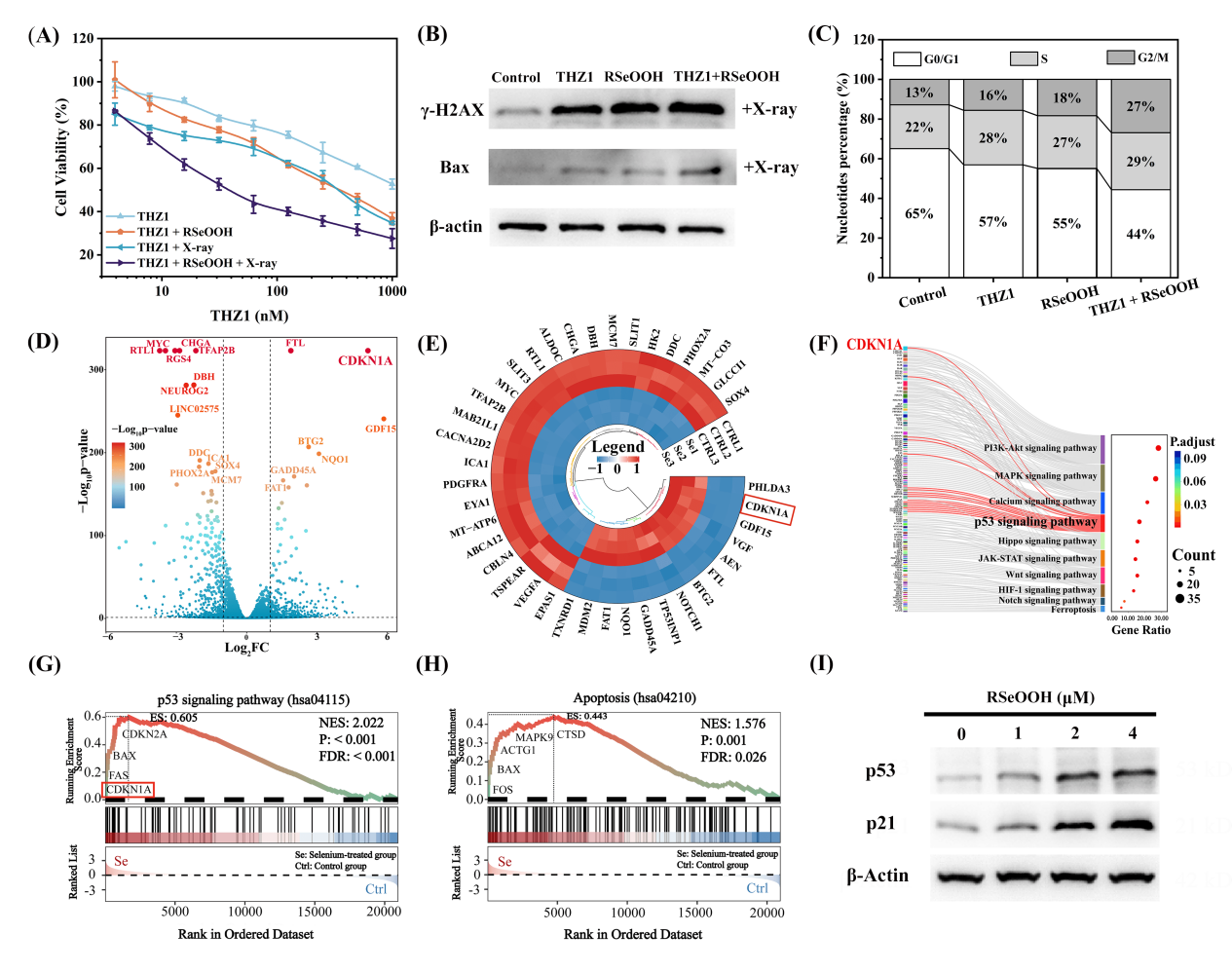
图1:RSeOOH调控p53信号通路和细胞凋亡,诱导细胞G2/M期阻滞
为解决该问题,研究团队设计了一种双重响应的靶向药物递送系统GE11-THZ1-NPs。该系统采用环状GE11肽修饰的双硒化物嵌段共聚物,可通过与表皮生长因子受体(EGFR)的特异性结合,实现对脊索瘤细胞的靶向识别与富集。在GE11-THZ1-NPs中,双硒键作为触发单元,在低剂量X射线照射和肿瘤微环境中高ROS水平的条件下发生断裂,转化为硒酸(RSeOOH),进而实现THZ1的响应性释放。RSeOOH与THZ1协同调控细胞周期蛋白表达,诱导细胞G2/M期阻滞,显著增强细胞对放射治疗所致DNA损伤的敏感性(图1)。相比传统治疗方式,该双重触发药物递送控释策略不仅提高了药物在肿瘤部位的蓄积效率,同时有效降低了THZ1的系统性脱靶毒性。该系统通过精准调控细胞周期,为脊索瘤的放化疗联合治疗提供了一种安全且具有良好前景的解决方案。

浙江大学生命科学学院为论文第一作者单位和通讯作者单位。周如鸿教授为通讯作者,其团队成员张连学博士为第一作者。苏州大学附属第一医院骨科滕云博士为共同第一作者,邹俊教授为该论文的共同通讯作者。该工作得到国家重点研发计划、国家自然科学基金项目、上海张江国家自主创新示范区重大项目、浙江大学丽水生命健康联合创新中心/丽水绿谷生命健康研究院以及浙江省自然科学基金等的资助。
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.5c04533