新生抗原肽疫苗疗法通过激活人体自身免疫系统来精准清除癌细胞,堪称现代肿瘤治疗领域最具智慧的策略之一。其核心奥秘在于,通过对肿瘤独特的“身份标签”(即新抗原)进行精巧改造,创造出能更强力、更有效地激活免疫系统的“超级诱饵”(即模拟表位)。然而,由于缺乏兼顾筛选效率与预测精度的技术体系,相较于区分“有效”与“无效”的粗略判断,我们对从海量候选中精准识别出“更优”分子的能力仍非常有限。值得关注的是,机器学习擅长处理多样性问题,而自由能微扰等物理方法则以其精确性见长,如何融合二者优势是解决此难题的典型挑战。因此,开发一种能融合数据知识与物理规律的智能筛选策略,以实现对更优疫苗候选分子的快速、精准发现,是亟待突破的核心技术瓶颈。
浙江大学生命科学学院周如鸿教授团队于2025年7月10日在Briefings in Bioinformatics上发表了一项题为“A free energy perturbation-assisted machine learning strategy for mimotope screening in neoantigen-based vaccine design”的突破性研究成果。该研究提出了一种名为自由能微扰辅助机器学习(FEPaML)的创新策略,首次通过贝叶斯优化将基于物理的炼金术自由能微扰(FEP)方法与基于知识的机器学习(ML)进行深度融合,旨在更加快速、精准地筛选出用于新抗原疫苗的模拟表位。

从“AI盲猜”到“物理-AI协同进化”——FEPaML策略实现疫苗分子的精准导航
传统机器学习方法在处理生物分子设计时,如同“广撒网”般筛选海量数据,虽能应对多样性,却难以精确区分结构高度相似的分子,导致在“优中选优”时力不从心。
研究首创的FEPaML策略则构建了一个“预测-验证-再学习”的闭环导航系统。该流程首先利用大型公开数据库对机器学习(ML)模型进行预训练,使其具备基础的“知识背景”。随后,该模型对所有候选分子进行初步预测,再由贝叶斯优化充当“决策大脑”,智能地选取最有价值的少数候选者,交由高精度的自由能微扰(FEP)方法进行物理计算验证,再利用双重损失函数,使模型能高效融合海量的粗糙知识数据与少量的高精度物理数据,进行迭代式自我优化。
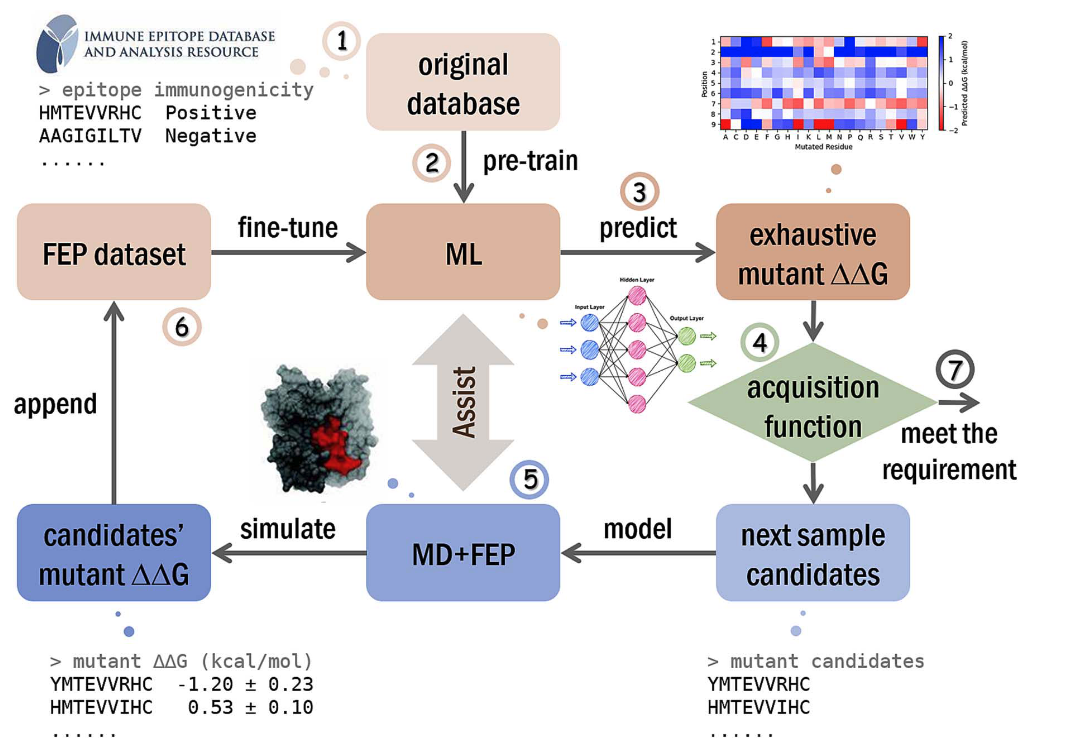
图1 FEPaML策略的工作流程

图2 机器学习部分的模型框架
该策略所开创的“小样本、高精度”新范式,有效解决了传统机器学习难以精确区分天然新抗原与其高相似度模拟表位的难题。研究表明,FEPaML仅需少量FEP计算样本,即可将局部预测精确度提升至0.9以上,显著优于现有模型。

图3 FEPaML和其他模型的比较
这项工作的核心价值在于,它有力地证明了在人工智能驱动的分子设计中,“专业化的高质量数据”在提升模型性能方面扮演着比复杂算法更关键的角色。同时也为个性化肿瘤疫苗的高效设计开辟了一条可扩展的智能路径,标志着AI驱动的免疫疗法正迈入一个“物理规律约束与数据智能融合”的深刻新阶段。
该工作由浙江大学定量生物中心及浙江大学上海高等研究院联合完成。浙江大学生命科学学院为论文第一作者单位与通讯作者单位,周如鸿教授为论文通讯作者,钟青庐博士为论文第一作者,陈骏博士、付蕾博士为共同作者。该研究由国家重点研发计划、国家自然科学基金、国家生物药技术创新中心、上海人工智能实验室、上海张江国家自主创新示范区重大项目、浙江大学上海高等研究院繁星科学基金、浙江大学全球合作伙伴基金资助。
原文链接:https://doi.org/10.1093/bib/bbaf254