生物如何感知并转导信号一直是生命科学领域的重要科学问题。解析感知和传递信号的分子基础是当前生命科学的前沿热点领域,其核心是挖掘和鉴定感受不同信号的受体蛋白。在植物中,这一领域最为典型的代表是作为植物体内传递生长发育和环境响应信号的关键物质之植物激素,其受体蛋白的鉴定一直是研究的焦点,相关成果陆续发表在Cell、Nature、Science上[1-5]。尽管植物如何感知内源激素信号已取得了长足的进展,但植物如何感受外部刺激、特别是土壤中各种离子的浓度变化、从而影响植物生长发育和作物产量的分子机制仍有待探索。近年来研究人员在植物细胞钠离子和硝酸盐离子的感知上取得了重要进展[6-8],但对其它离子感知机制的认识仍是空白。
铝(Al)离子毒害是酸性土壤上限制作物生产的主要因素,也是酸沉降导致森林退化的重要原因,威胁着全球农业和生态环境安全[9]。同时,铝也是引起阿尔茨海默症等人类疾病的潜在重要风险因子[10]。全球约有30-40%的可耕地和 50%的潜在耕地属于酸性土壤[11]。我国拥有面积达218万km2的酸性土壤,其主要分布于南方,约占国土总面积的22.7%,且酸化有不断加剧的趋势[12]。长期的进化使植物获得了多种抗铝毒机制,其中受核心转录因子STOP1调控的、铝诱导根系分泌小分子有机酸(苹果酸、柠檬酸等)是一个关键且保守的机制。但植物如何感知铝离子并将信号传递至STOP1进而启动抗铝响应这个最关键的科学问题仍不清楚。
2024年1月10日,浙江大学郑绍建教授课题组在Cell Research在线发表了题为“The LRR receptor-like kinase ALR1 is a plant aluminum ion sensor ”的研究论文,发现了首个细胞铝离子受体,并揭示了从铝离子感知到下游解毒机制启动的完整信号通路,是植物抗铝研究的一个重大突破,同时也是植物生物学领域,特别是细胞感知离子及其信号转导途径研究的重大进展,为今后进一步挖掘细胞离子受体打开了一扇新的大门。

该研究首先通过大量类受体激酶(Receptor-Like Kinase, RLK) T-DNA插入突变体的铝敏感性筛选,获得了一个特异性响应铝的超敏感突变体alr1-1(aluminum resistance 1)。ALR1编码一个已知的植物磺肽素(PSK)受体PSKR1,在植物生长发育和抗生物逆境中发挥重要功能[13,14]。该研究通过一系列翔实的生理、生化、分子、遗传等证据证明了PSKR1/ALR1的激酶域同时是一个铝离子受体,并解析了其下游的完整信号转导通路。铝离子与ALR1激酶结构域的结合促使其招募共受体BAK1,进而促进ALR1磷酸化NADPH氧化酶RbohD,从而刺激ROS的产生。ROS通过氧化修饰F-box蛋白RAE1进而抑制抗铝核心转录因子STOP1的蛋白降解,促进其累积,从而激活下游有机酸转运蛋白基因的表达和根系有机酸的分泌,使植物表现出抗铝性(图1)。
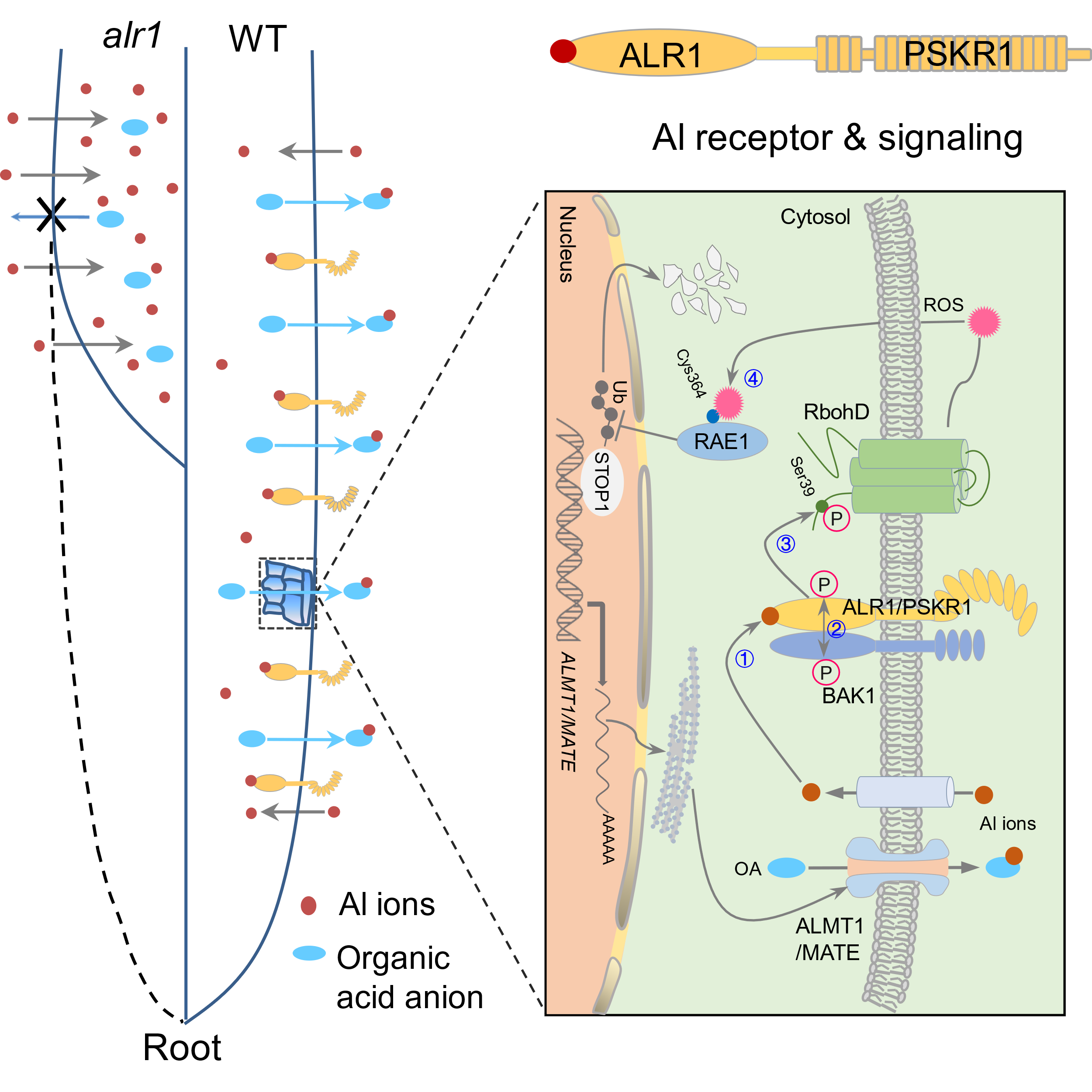
图1. ALR1介导的铝感知及信号转导途径
该研究的主要亮点在于:
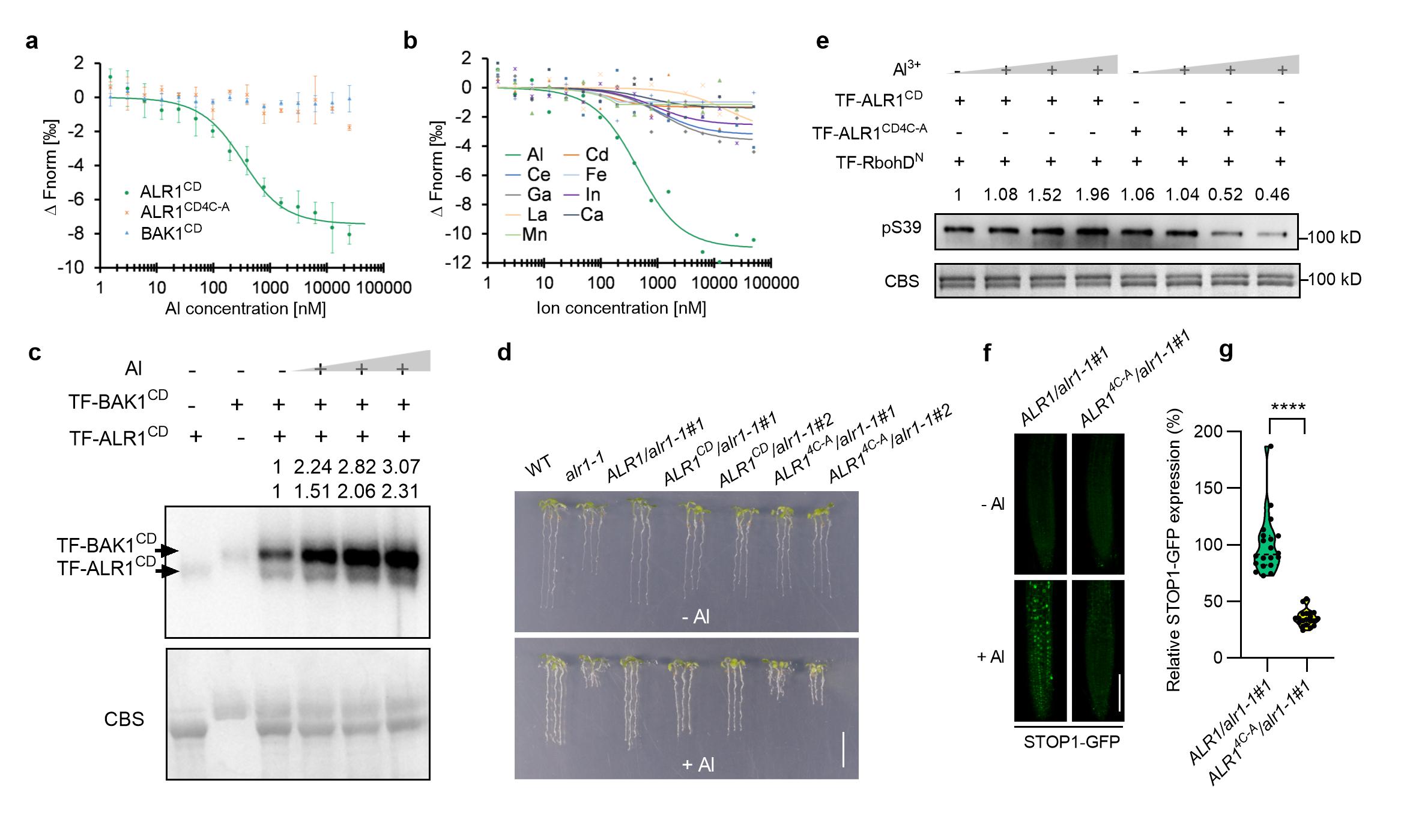
(1)发现首个细胞铝离子受体ALR1。支持其作为受体的证据包括(图2):(1)ALR1的激酶结构域可以特异性地结合铝离子;(2)铝离子的结合可以促使ALR1招募共受体BAK1,进而促进ALR1对下游RbohD Ser39位点的磷酸化,启动ROS的释放;(3)ALR1对BAK1和RbohD的磷酸化响应铝离子的浓度变化,并赋予STOP1的蛋白累积产生相应改变;(4)ALR1激酶域中Cys939/944/985/987位点的突变不影响其本身的结构和行使PSK受体的功能,但丧失了结合铝离子和介导STOP1蛋白累积的能力,阻断了抗铝信号转导通路。该研究发现的铝离子受体ALR1是生物体中第一个行使离子受体功能的激酶,这为今后鉴定其他离子的受体提供了新的思路。
(2)揭示RbohD介导的早期ROS信号是细胞铝信号转导通路中的关键第二信使,其将细胞质中铝信号的感知与细胞核内铝信号的转导紧密联系在一起(图3),而以往报道的铝毒下检测到的ROS其实是铝毒的结果而非起因。同时, ROS能够直接作用于蛋白降解机制,也为理解生物体中ROS的信号转导提供了新的视角。研究人员发现短时间铝处理就能在根尖检测到ROS信号,并且这些ROS的产生依赖于RbohD和ALR1,而产生的ROS通过对介导STOP1蛋白降解的F-box蛋白RAE1 Cys364位点的氧化修饰,抑制了其对STOP1蛋白的泛素化降解,促进STOP1蛋白累积,启动其对有机酸转运蛋白基因ALMT1和MATE的转录和有机酸释放。
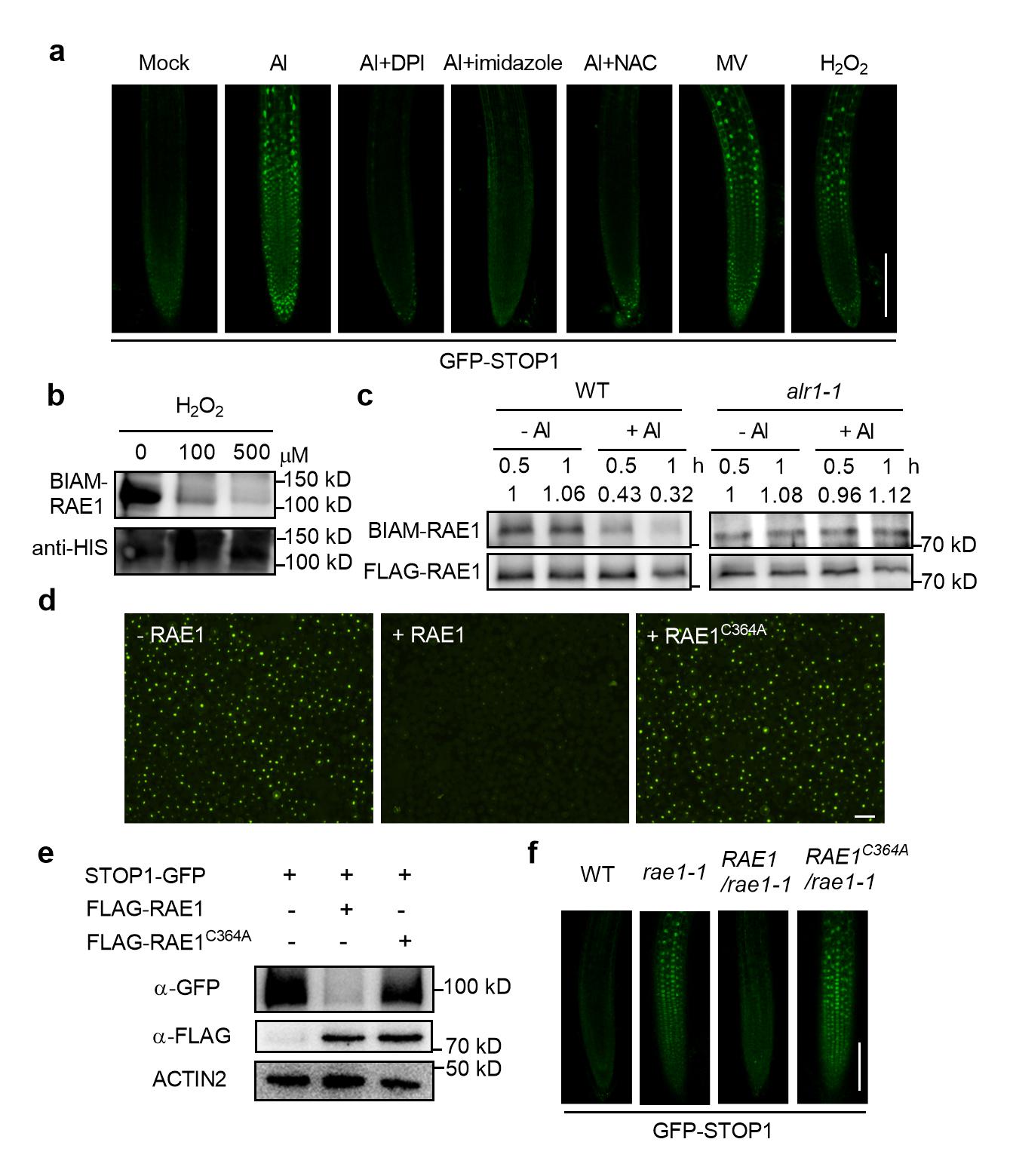
图3. ROS是抗铝信号转导的关键第二信使
(3)阐明ALR1作为一个特殊的受体蛋白行使感知和介导生长信号和逆境信号的双重功能。ALR1的胞外结构域接收PSK信号,胞内结构域感知铝离子胁迫。该研究证明两者的感知机制是独立的(图4),并且铝促进ALR1与共受体BAK1的互作依赖于两者的胞内结构域,而PSK的促进依赖于胞外结构域。在正常条件下,ALR1感知PSK信号促进根系生长;在铝胁迫下,PSK信号减弱,ALR1通过感知胞内铝离子启动抗铝反应。这种机制丰富了人们对受体功能的认知,也为植物平衡生长发育和逆境响应提供了新的见解。同时,该研究建议今后将该基因命名为PSKR1/ALR1,以便能更准确地反应该蛋白的双重功能。
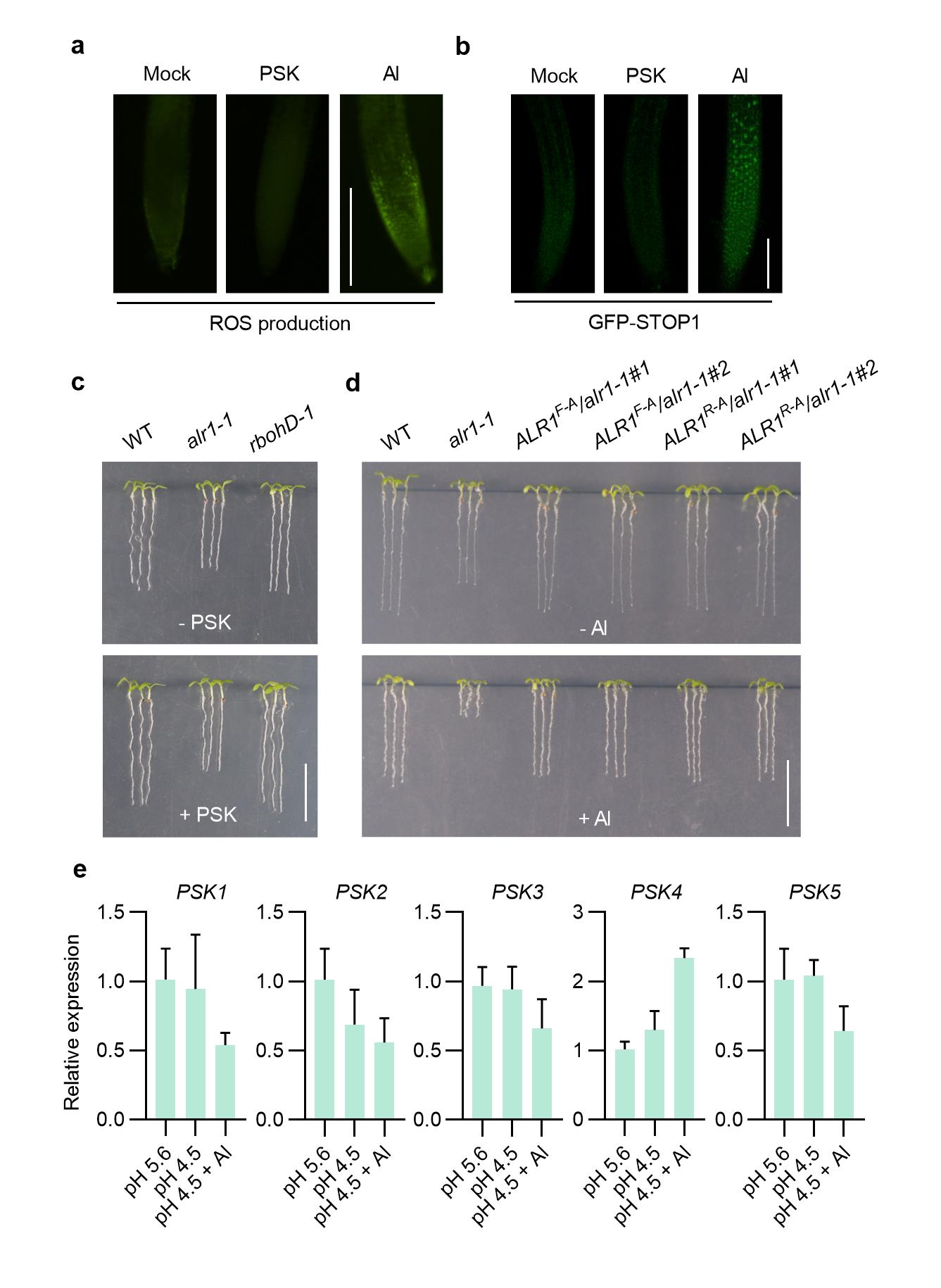
图4. ALR1的铝离子感知独立于PSK感知
值得一提的是,该研究小组前期已成功解析了苹果酸转运蛋白ALMT1的高分辨率结构,并阐明了胞外铝离子直接激活ALMT1进而分泌苹果酸解铝毒的分子机制[15]。结合本研究,该研究小组系统阐明了植物从细胞外和胞内感知与应答铝离子的分子机制:到达根细胞表面的铝离子首先激活ALMT1等有机酸转运蛋白触发有机酸释放,进而螯合铝离子使其失活;而冲破有机酸防护层进入到胞内的铝离子则被ALR1感知,进而启动信号转导,促进更多的ALMT1等功能蛋白的合成,从而拉开了细胞抗铝全面防御战的序幕。这些发现将为未来抗铝作物和树木的分子育种提供理论依据,对维持农业生产和全球粮食安全,以及森林恢复和全球生态环境改善具有潜在助力,也为治疗由铝引起的人类疾病(如阿尔兹海默症)提供潜在线索。
浙江大学生命科学学院郑绍建课题组丁忠杰研究员和博士研究生徐晨为该论文的共同第一作者,郑绍建教授为通讯作者。此外,中科院遗传所的周俭民研究员、法国IPS2研究所的Moussa Benhamed教授和英国牛津大学的Nicholas Harberd教授等合作者也为该研究作出了重要贡献。该研究受国家自然科学基金、科技部“973”计划项目、国家重点研发计划和广东岭南现代农业实验室专项资金等的资助。
原文链接:https://www.nature.com/articles/s41422-023-00915-y
参考文献:
1. Kepinski S, Leyser O. (2005) The Arabidopsis F-box protein TIR1 is an auxin receptor. Nature 435: 446-451.
2. Kinoshita T, Cano-Delgado A, Seto H, Hiranuma S, Fujioka S, Yoshida S, Chory J. (2005) Binding of brassinosteroids to the extracellular domain of plant receptor kinase BRI1. Nature 433: 167-171.
3. Santiago J, Dupeux F, Round A, Antoni R, Park SY, Jamin M, Cutler SR, Rodriguez PL, Márquez JA. (2009) The abscisic acid receptor PYR1 in complex with abscisic acid. Nature 462: 665-668.
4. Ding Y, Sun T, Ao K, Peng Y, Zhang Y, Li X, Zhang Y. (2018) Opposite Roles of Salicylic Acid Receptors NPR1 and NPR3/NPR4 in Transcriptional Regulation of Plant Immunity. Cell 173: 1454-1467.
5. Yu Y, Tang W, Lin W, et al. (2023) ABLs and TMKs are co-receptors for extracellular auxin. Cell 186: 5457-5471.
6. Ho C-H, Lin S-H, Hu H-C, Tsay Y-F (2009) CHL1 functions as a nitrate sensor in plants. Cell 138: 1184-1194.
7. Jiang Z, Zhou X, Tao M, et al. (2019) Plant cell-surface GIPC sphingolipids sense salt to trigger Ca2+ influx. Nature 572: 341-346.
8. Liu K-L, Liu M, Lin Z, et al. (2022) NIN-like protein 7 transcription factor is a plant nitrate sensor. Science 377: 1419-1425.
9. Godbold DL, Fritz E, Huttermann A (1988) Aluminum toxicity and forest decline. Proc Natl Acad Sci USA 85: 3888-3892.
10. Perl DP, Brody AR (1980) Alzheimer's disease: X-ray spectrometric evidence of aluminum accumulation in neurofibrillary tangle-bearing neurons. Science 208: 297-299.
11. Vonuexkull HR, Mutert E (1995) Global Extent, Development and Economic-Impact of Acid Soils. Plant Soil 171: 1-15.
12. 沈仁芳 (2008) 铝在土壤-植物中的行为及植物的适应机制 (铝在土壤-植物中的行为及植物的适应机制).
13. Wang J, Li H, Han Z, et al. (2015) Allosteric receptor activation by the plant peptide hormone phytosulfokine. Nature 525: 265-268.
14. Mosher S, Seybold H, Rodriguez P, et al. (2013) The tyrosine-sulfated peptide receptors PSKR1 and PSY1R modify the immunity of Arabidopsis to biotrophic and necrotrophic pathogens in an antagonistic manner. Plant J 73: 469-482.
15. Wang J, Yu X, Ding ZJ, et al. (2022) Structural basis of ALMT1-mediated aluminum resistance in Arabidopsis. Cell Res 32: 89-98.