英国Nature杂志在4月3日在线发表了浙江大学生命科学学院陈军教授实验室与彭金荣教授合作的最新研究成果“PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components”。该研究揭示了遗传补偿效应的分子机制。
生命中的遗传物质DNA时时刻刻都会受到损伤的威胁,这些威胁有来自于内在的因素比如:细胞分裂,正常细胞代谢产生的活性氧;也有来自于外在因素比如:紫外及离子辐射,化学诱变剂等。每个细胞的基因组DNA每天会遇到差不多104次损伤。DNA损伤会产生基因上的变异,这些变异在生命进化中扮演着重要的角色。但其中很多变异会使编码蛋白的基因失去功能,如果变异的基因功能非常重要,机体又不采取措施,它就不能存活,就失去了生命的意义。为了存活,所以生命就进化出许多机制来应对基因突变这一状况,其中之一就是“遗传补偿效应”(Genetic compensation response),即某一基因发生突变彻底失去功能后,机体会采取相应的机制,提高其它基因的表达来代替这一基因的功能,从而能够正常发育存活。这种奇怪的现象一直困惑着生命学界,它背后的分子机制是什么?在此之前还不得而知。我们这项研究对其进行了探讨。
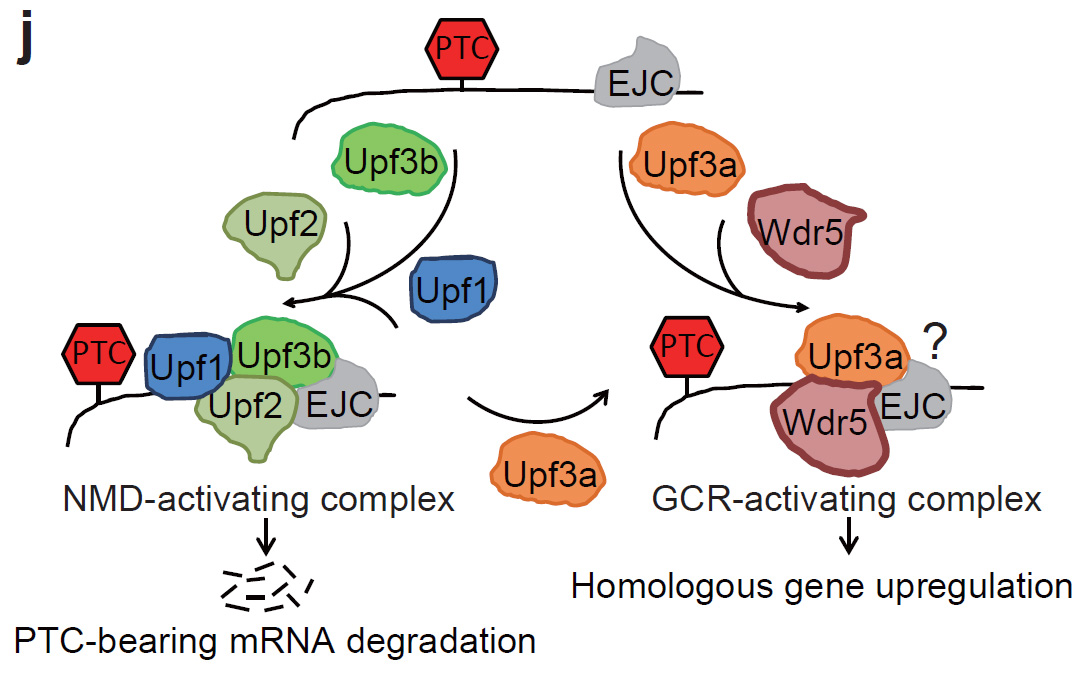
在阐述“遗传补偿效应”分子机制之前,还得介绍无义突变mRNA介导的降解途径,这个降解途径我们简称为“NMD”途径(Nonsense mRNA Mediated Decay pathway),这是一个细胞内mRNA质量监控机制。例如某个基因发生无义突变,及转录出来的mRNA由于突变会形成提前终止密码,这样的突变一般称为无义突变。如果继续将其翻译出来,将会产生一个比正常有功能蛋白短一些的蛋白,通常这样短蛋白不仅没有功能,反而会有不好的副作用,所以细胞就会通过NMD监控途径降解这样的无义突变mRNA。让人困惑是科学家发现此种途径可能存在两个分支,一个分支为Upf3b基因介导的降解,另一个Upf3a分支在无义突变mRNA降解中作用并不明显,但它存在的意义并不十分清楚。
在我们前期的一些研究中,“遗传补偿效应”对我们研究一些斑马鱼基因的功能起着巨大的障碍作用,比如我们在研究一个钙调蛋白酶Capn3a时发现,用不同方法敲低此基因会出现小肝脏表型,我们根据这一结果构建该基因敲除遗传突变体,结果这个突变体发育正常没有表型。因此,我们利用这一斑马鱼突变体对“遗传补偿效应”这一科学问题进行了探讨:首先我们通过构建此基因不同突变体,发现只有无义突变才激活“遗传补偿效应”,此效应是通过提高与此基因序列同源的家族基因表达来进行的;接着,我们通过向斑马鱼体内导入外源DNA构建转基因,证明这种体内“遗传补偿效应”,还可以通过转基因来实现。及只要外源导入的转基因带有无义突变和同源序列,就可以提高体内具有同源序列的基因表达;由于无义突变才能激活“遗传补偿效应”,为此我们想到“NMD”途径可能于此相连,通过构建双突变体,我们发现,非常有意思的是负责无义突变mRNA降解的因子如上面提到的Upf3b,以及Upf1对于“遗传补偿效应”来讲都不需要,而不参与降解的Upf3a对于“遗传补偿效应”来讲是必需的。无义突变mRNA并不是与以前想象的一样,一无用处,无义突变mRNA的转录,翻译,以及它的完整性对于“遗传补偿效应”都是必需的;最后,我们进一步揭示Upf3a可以与一个叫COMPASS的复合体结合,COMPASS复合体可以将核小体中的组蛋白H3第4位赖氨酸进行3甲基化,改变染色体的结构从而促进基因表达。
我们根据所得到的研究结果,提出“遗传补偿效应”的分子机制模型:转录后被识别的无义突变mRNA可以与Upf3b结合,也可以与Upf3a结合,如果与Upf3b,它将被NMD途径降解;如果它与Upf3a结合,Upf3a将招募COMPASS复合体,无义突变mRNA利用核酸序列同源性,将Upf3a/COMPASS(?)带到其家族同源基因的基因组DNA处,改变其组蛋白修饰,促进同源基因表达,弥补本身的功能损失。
“遗传补偿效应”并不是斑马鱼独有的现象,在其它模式生物中同样存在比如:小鼠,拟南芥。来自于不同实验室的人类基因组测序结果显示,在正常人群的基因组中存在着大量携带有纯合无义突变的基因,其中有些基因的错义突变会引起严重的人类遗传疾病。我们推测“遗传补偿效应”是产生这一现象的重要原因。这项发现,不仅仅是在理论上取得大的突破,而且还有实践价值。例如,“遗传补偿效应”对机体存活具有重要意义,但对于基因功能研究是一个巨大的障碍。斑马鱼超过80%的基因被敲除后没有表型,所以很难研究这些基因的功能,这其中大部分是由于“遗传补偿效应”导致。针对这一问题,现在就可以根据我们发现的机理,用不同方法阻断“遗传补偿效应”即可,比如,敲低/除Upf3a;并且还会为一些错义突变引起人类遗传疾病的治疗,提供新方法和新思路,比如:引入一个无义突变,或通过转基因激活家族基因的表达弥补其功能。
浙江大学生命科学学院为论文第一作者单位,陈军教授为该论文的通讯作者,彭金荣教授为共同通讯作者,陈军实验室博士后马志鹏为该论文第一作者。该项目得到国家重点研发计划资助。
全文链接:https://doi.org/10.1038/s41586-019-1057-y