美国科学院院刊PNAS在4月2日在线发表了浙江大学生命科学学院易文教授实验室的最新研究成果“O-GlcNAcylation of Core Components of the Translation Initiation Machinery Regulates Protein Synthesis”。该研究报道了O-连接乙酰葡糖胺(O-GlcNAc)糖基化修饰调控细胞中蛋白翻译的新机制。
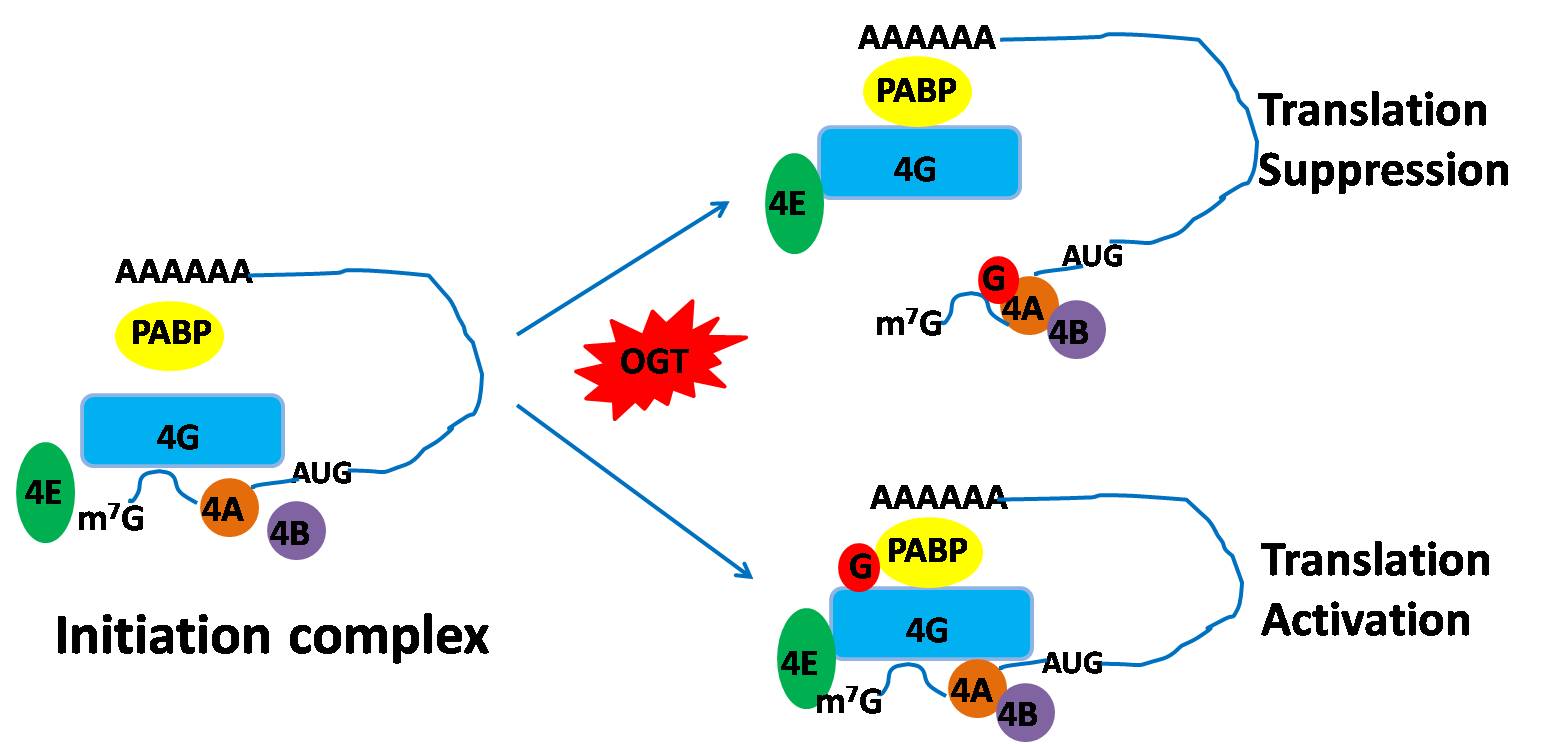
蛋白翻译是细胞生命活动的最基本的生物过程之一。在细胞内蛋白翻译是受到多种途径的精确调控。蛋白翻译的失调与许多重大疾病的发生发展密切相关。O-GlcNAc糖基化修饰是在糖基转移酶OGT的催化下以O-糖苷键形式共价连接到蛋白质的丝氨酸或苏氨酸羟基上的单糖修饰。目前的研究表明,O-GlcNAc糖基化在基因转录调控、细胞信号传导通路、细胞周期调控、应激反应、免疫识别、代谢重编程等许多生理过程中起着重要的作用。在本研究中,易文教授课题组首先发现蛋白翻译的起始阶段(也是翻译过程的限速步骤)中两个关键的蛋白因子(eIF4A和eIF4G)具有O-GlcNAc糖基化修饰。进一步的研究发现eIF4A在丝氨酸322/323 位点上的糖基化修饰降低了eIF4A1与eIF4G1的互作,抑制了翻译起始复合物eIF4F 的装配;同时,糖基化修饰还抑制了eIF4A对mRNA 的解旋酶活性,从而抑制新蛋白的合成。另一方面,eIF4G在丝氨酸61位上的糖基化修饰则促进了eIF4G1与多聚A mRNA结合蛋白(PABP)的互作,增强与多聚A-mRNA 的结合,促进蛋白的合成。因此,O-GlcNAc糖基化对蛋白翻译具有重要的调控作用。
这项工作首次揭示了O-GlcNAc糖基化在调控蛋白翻译起始过程中的重要作用和分子机制,提出了O-GlcNAc糖基化对翻译因子功能的差异性调控是细胞对蛋白翻译的精确调控的方式之一,拓展了对蛋白翻译这个基本生物学过程的认识。相关分子机制的揭示将为O-GlcNAc糖基化作为肿瘤等重大疾病的新靶点,开发新的治疗策略提供重要的理论和实验基础。
浙江大学生命科学学院为论文第一作者单位,易文教授为该论文的通讯作者,易文课题组博士后李雪霞和博士研究生朱强为该论文第一作者。该项目得到国家自然科学基金委重大研究计划、国家重点研发计划、浙江省杰出青年基金的资助。
全文链接:https://www.pnas.org/content/early/2019/04/01/1813026116