2017年9月19日,美国科学院院刊(PNAS)在线发表了浙江大学生命科学学院博士生吴梦瑞题为“Cbfβ governs osteoblast-adipocyte lineage commitment through enhancing β-catenin signaling and suppressing adipogenesis gene expression”的研究论文(导师为浙江大学生命科学学院客座教授,阿拉巴马大学医学院李亦平教授;合作导师是浙江大学生命科学学院邵建忠教授)。
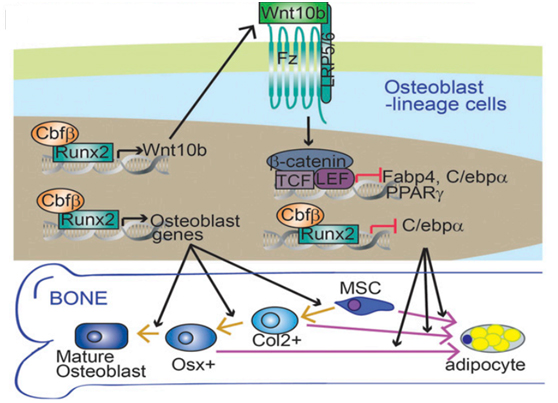
骨骼由填充有骨细胞的矿物质和蛋白质支架构成。这种结构不断分解和更新。当骨丢失率超过替代率时,骨骼减弱,最终导致称为骨质疏松症的状况。许多因素可能有助于骨质疏松症,包括老化,某些药物和激素变化。成骨细胞,构建骨的细胞来源于骨髓间充质干细胞。这些骨骼干细胞也可以产生其它类型的细胞,包括脂肪细胞。老年人的骨髓骨骼造骨细胞和脂肪细胞比年轻人更少。然而,负责这些变化的机制是未知的。在本研究中,该小组研究了Cbfβ如何影响小鼠的骨髓干细胞分化。他们在成骨细胞发育的三个不同阶段删除了Cbfβ基因:间充质干细胞,中间阶段和早期成骨细胞。Cbfβ缺陷在分化的所有三个阶段均降低了小鼠的骨密度,并显着增加了骨髓的脂肪含量。进一步测试证实,Cbfβ缺陷小鼠骨髓中的脂肪细胞比对照小鼠多。 Cbfβ缺陷小鼠的骨骼与老年对照小鼠的骨骼类似。老年对照小鼠的Cbfβ水平也显着低于对照小鼠。这些结果表明,Cbfβ的下降可能有助于从成骨细胞到脂肪细胞生产的年龄相关转移。
一系列实验室实验证实,没有Cbfβ,成骨细胞分化任何阶段的细胞都可以转化成脂肪细胞。 Cbfβ通过称为Wnt /β-连环蛋白的重要细胞信号通路抑制脂肪细胞的形成。它还抑制调节称为c /ebpα的脂肪细胞形成的基因的表达。该小组表明,Cbfβ通过这两种机制在维持成骨细胞谱系中起关键作用。“我们的数据详细介绍了引起祖细胞和早期成骨细胞产生脂肪细胞而不是骨产生细胞的潜在途径,”李亦平教授说。 “他们还建议维持Cbfβ可能是预防人们与年龄相关的骨质疏松症的有效途径。”然而,这个想法仍然需要在人体中进行测试。这项工作由NIH的国家关节炎和肌肉骨骼和皮肤病研究所(NIAMS)和国家牙科和颅面研究所(NIDCR)资助。结果于2017年9月19日在美国国家科学院院刊上发表。
浙江大学生命科学学院为第一作者单位,吴梦瑞博士为文章第一作者,王祎萍, 邵建忠教授,陈微教授为共同作者,李亦平教授为通讯作者。该成果相继在UAB官网(http://www.uab.edu/news/innovation/item/8714-researchers-describe-mechanism-that-underlies-age-associated-bone-loss)和美国国立研究院官网(https://www.nih.gov/news-events/nih-research-matters/mechanisms-age-related-bone-loss )上专题报道。